рассчитайте массу сложного эфира полученного при взаимодействии этанола массой 92 г,с уксусной кислотой ,если выход продукта реакции от теоретически возможного составляет 80 процентов,решение задачи
Ответы
Ответ дал:
0
дано:
м(этанол)= 92 г
+уксусная кислота = этилацетат
реш:
(реакцию см на картинке)
получается Этиловый эфир уксусной кислоты (этилацетат)
n(этанол) = 92/46 = 2 моль
так как перед формулами веществ не стоит коэффициентов, этилацетата тоже 2 моль.
m(этилацетат)= 2*88.1 =176,2г
это теор.
176,2 =100 %
x =80% следовательно 176,2 *80 /100 = 140,96 г
масса сложного эфира = 140,96 г
Приложения:
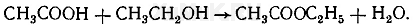
Похожие вопросы
2 года назад
7 лет назад
7 лет назад
10 лет назад
10 лет назад
10 лет назад