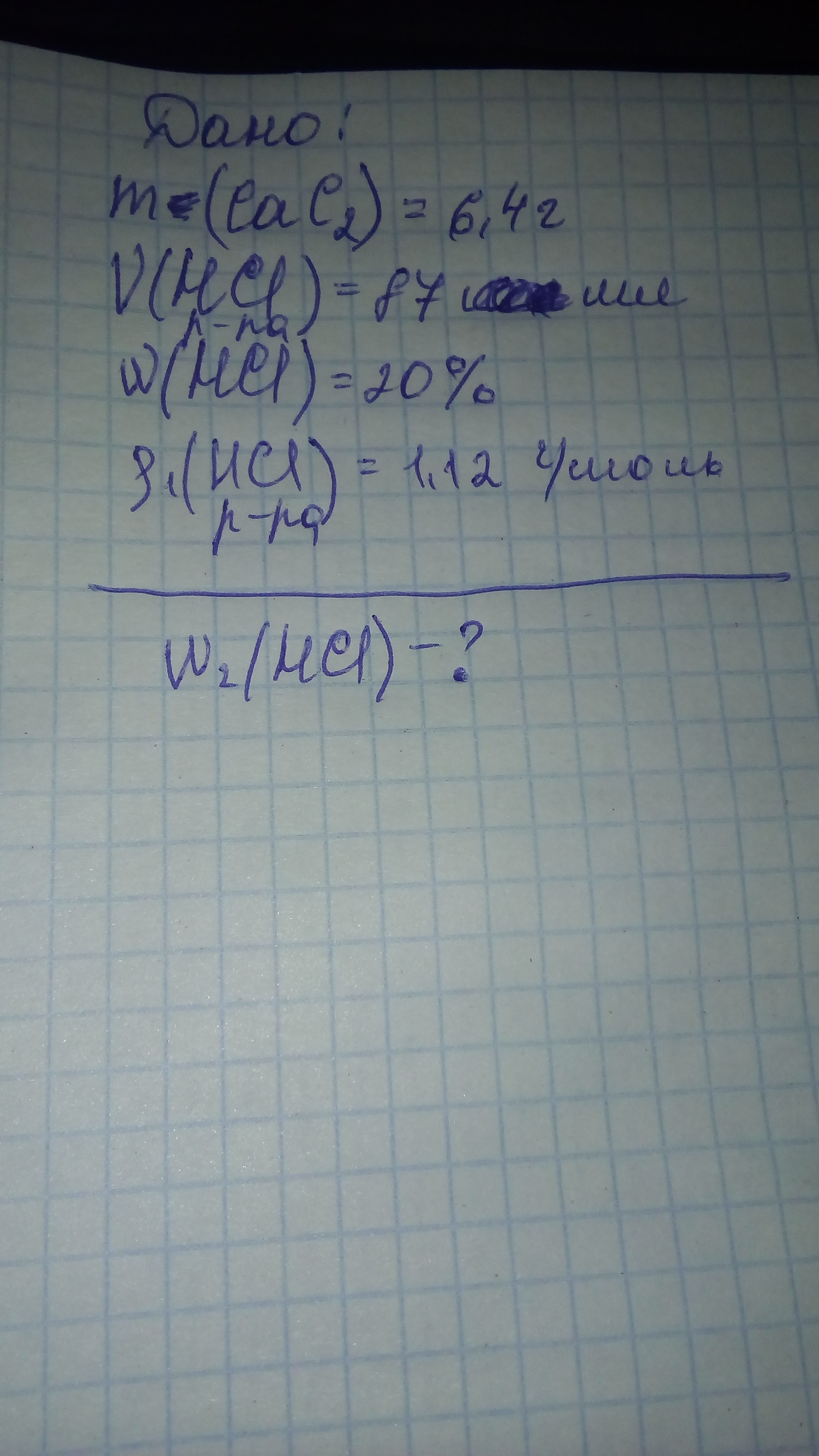Ответы
Ответ дал:
0
CaC2 + 2H2O = Ca(OH)2 + C2H2 Ca(OH)2 + 2HBr = CaBr2 + 2H2O n(CaC2) = 6,4/64 = 0,1 моль. m(HBr чистого) = V*p*w = 87*1,12*0,20 = 19,49 г. Из уравнения реакции следует, что n(CaC2) = n(Ca(OH)2) = n(C2H2), а также что n(HBr прореагировавшего) = 2n(Ca(OH)2) = 0,2 моль. Тогда m(HBr прореагировавшего) = n*Mr = 0,2*81 = 16,20 г. m(HBr осталось) = 19,49 - 16,20 = 3,29 г.
Ответ дал:
0
Но там вeдь нe HBr , a HCl
Ответ дал:
0
C HBr и в интернете есть, мне нужна задача с HCl, как и написано в условиях.задачи
Ответ дал:
0
У них одинаковые степени окисления и св-ва, вам стоит лишь заменить буквы, это и так ясно
Ответ дал:
0
Спасибо
Похожие вопросы
2 года назад
2 года назад
2 года назад
2 года назад
8 лет назад
9 лет назад