В бассейн площадью 750 м² и глубиной 2 м попала крупинка соли NaCl массой 0,58 мг. Определите (в миллиардах) количество ионов Натрия в 1 см³ воды через длительное время. Считайте, что постоянная Авогадро равна 6 · 10²³ моль⁻¹; молярная масса соли - 0,058 кг/моль.
Ответы
Ответ дал:
0
1) Найдем количество молей соли, попавших в воду:
0,058 кг/моль=58 г/моль
0,58 мг= 5,8*10⁻³г
n=5,8*10⁻³г/58 г/моль=10⁻⁴ моль.
2) Найдем количество молей натрия после длительного времени:
Na⁺cl⁻<=>Na⁺+cl⁻.
Значит моль => общее количество ионов
атомов
3) Найдем общий объем бассейна:
V=750 м² * 2 м = 1500 м³=1,5*10⁹ см³
4) Найдем количество ионов натрия в 1 см³:
ρ=N/V=6*10¹⁹/1.5*10⁹=4*10¹⁰=40 млрд атомов/см³
Ответ: 40 млрд атомов/см³
Ответ дал:
0
Только в ответах написано просто 4
Ответ дал:
0
Возможно я где-то со степенью ошибся
Ответ дал:
0
Спасибо!
Ответ дал:
0
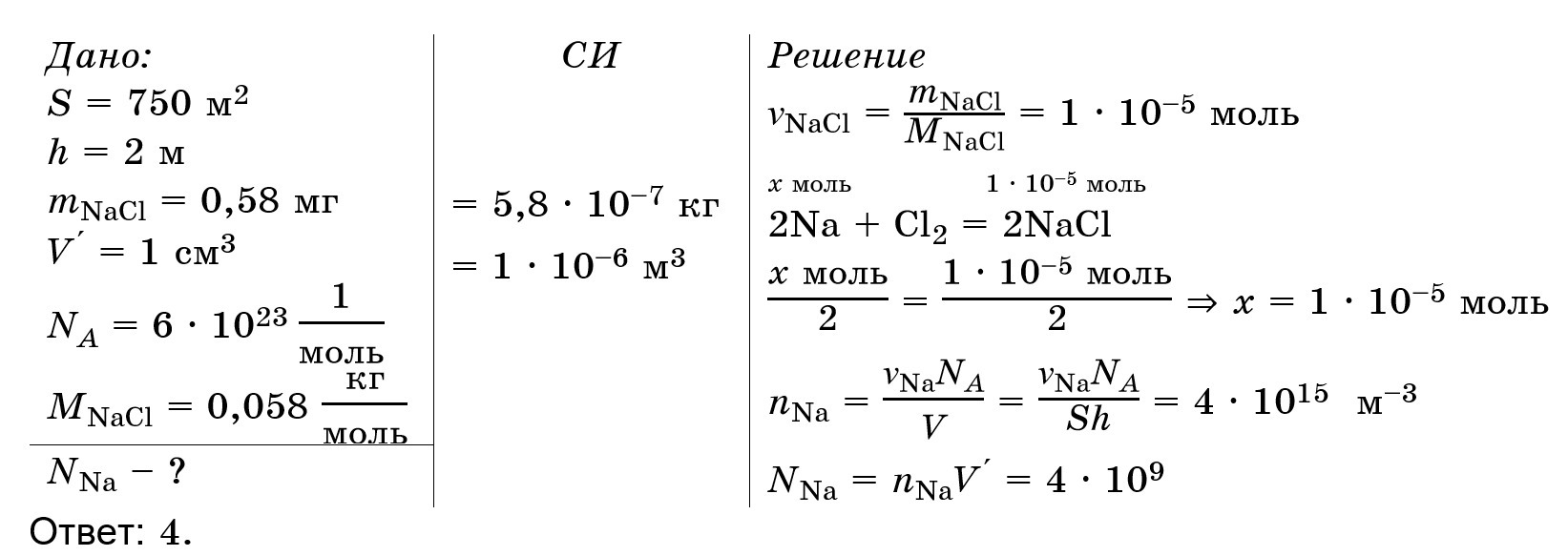
Для начала из курса химии узнаем количество вещества из реакции 2Na + Cl₂ = 2NaCl, зная количество вещества соли NaCl.
После этого определим концентрацию Натрия в бассейне.
И дальше определим количество ионов Натрия в 1 см³ бассейна.
См. вложение.
Приложения:
Ответ дал:
0
В некоторых книгах так пишут, вот и я так написал.
Ответ дал:
0
понятно
Ответ дал:
0
А как Вы эти линии начертили?) Я так тоже хочу научится)))
Ответ дал:
0
Создаёшь таблицу => ненужные линии вытираешь ластиком. Всё.
Ответ дал:
0
Ого
Похожие вопросы
2 года назад
2 года назад
2 года назад
2 года назад
8 лет назад
8 лет назад