1) Сколько литров водорода получится при взаимодействии 13 г цинка с соляной кислотой?
2) Осуществить превращения. Последнюю реакцию обмена рассмотреть в точки зрения ТЭД.
Cu ---> CuO ---> CuSO4 ---> Cu(OH)2
Ответы
Ответ дал:
0
дано:
m (Zn) = 13г
найти: V (H2)-?
решение:
Zn + 2HCl ----> ZnCl2 + H2
n = m/M
n(Zn)= 13г / 65г/моль
по ур- ию Zn/H2 = 1/1, соответственно, n(H2) = 0,2 моль
V= Vт * n
V (H2) = 22,4 л/моль * 0,2 моль = 4,48л
Приложения:
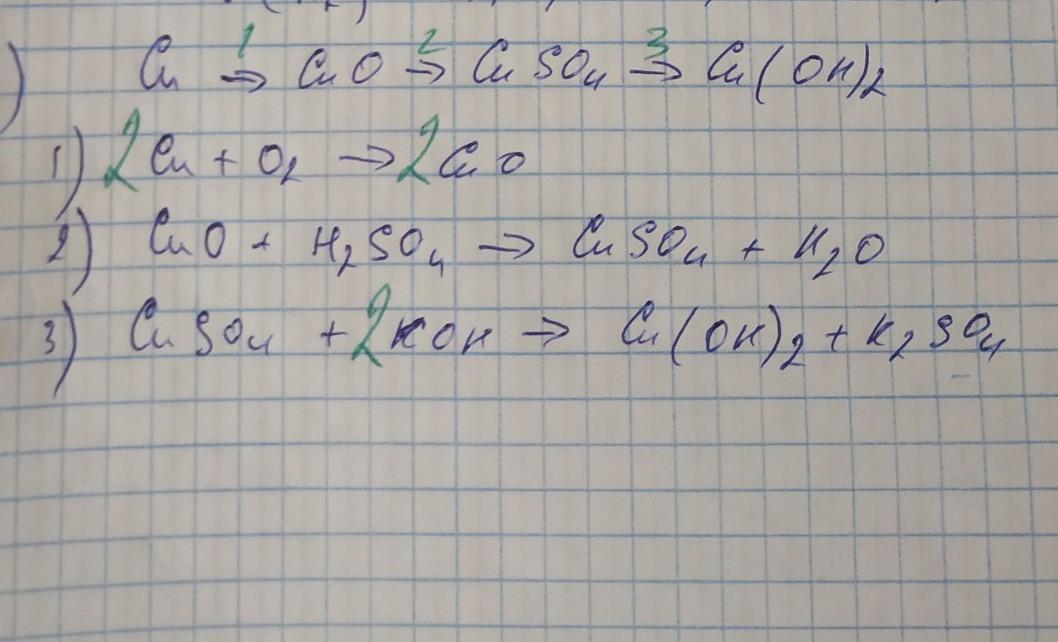
Похожие вопросы
2 года назад
2 года назад
2 года назад
8 лет назад
8 лет назад
9 лет назад
9 лет назад