Ответы
Ответ дал:
0
500г х л
CaCO3 = CaO + CO2
1 моль 1 моль
1. определим массу чистого карбоната в известняке
массовая доля чистого карбоната = 100-90 = 10% или 0,1
m(CaCO3) = 500 * 0.1 = 50г
2. Находим кол-во карбоната
кол-во = масса / молярную массу M(CaCO3) = 100г/моль
v(caCO3) = 50/100=0.2 моль
по уравнению реакция углекислый газ и карбонат в одномолярных отношениях, следовательно
v(CO2) = v(CaCO3) = 0.2 моль
3. Объем газа = кол-во * молярный объем
V = v * Vm Vm = 22.4л/моль
V(CO2) = 0.2 * 22.4 = 4.48л
Ответ дал:
0
решение в приложении ниже
Приложения:
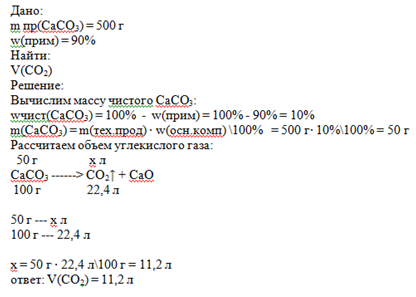
Похожие вопросы
2 года назад
2 года назад
7 лет назад
7 лет назад
10 лет назад
10 лет назад
10 лет назад