помогите решить)
10,7 хлорида аммония смешали с гидроксидом кальция и смесь нагрели. Какой газ и сколько его по массе и объему выделилось. срочно)
Да и еще откуда там шесть появилось?)
Приложения:
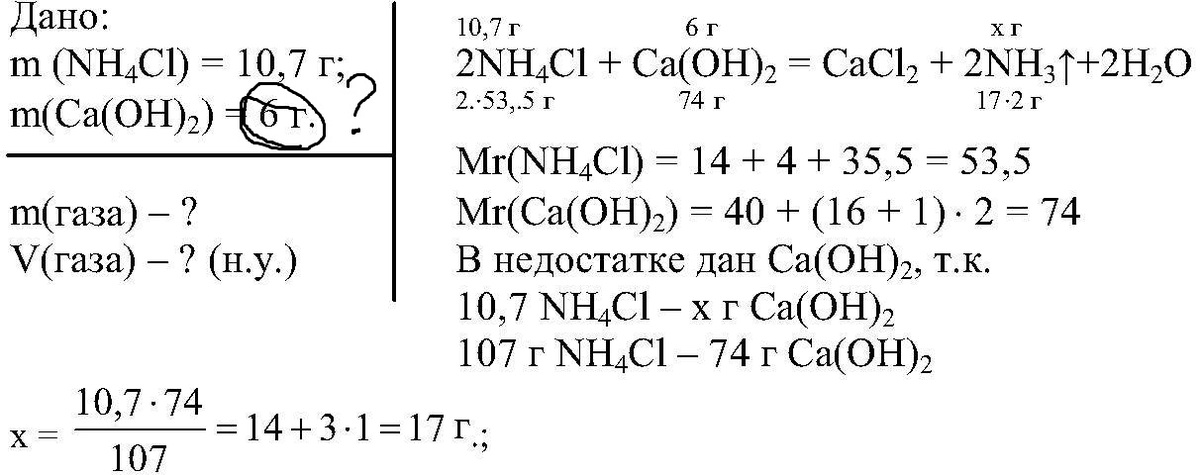
Ответы
Ответ дал:
0
2NH4Cl + Ca(OH)2 -----> CaCl2 + 2NH3 + 2H2O
n(NH4Cl) = 10,7 г / 53,5 г / моль = 0,2 моль
n(NH4Cl) = n(NH3) = 0,2 моль
V(NH3) = 0,2 моль * 22,4 л / моль = 4,48 л
m(NH3) = 0,2 моль * 17 г / моль = 3,4 г
Ответ: V(NH3) = 4,48 л, m(NH3) = 3,4г
n(NH4Cl) = 10,7 г / 53,5 г / моль = 0,2 моль
n(NH4Cl) = n(NH3) = 0,2 моль
V(NH3) = 0,2 моль * 22,4 л / моль = 4,48 л
m(NH3) = 0,2 моль * 17 г / моль = 3,4 г
Ответ: V(NH3) = 4,48 л, m(NH3) = 3,4г
Похожие вопросы
2 года назад
2 года назад
10 лет назад
10 лет назад
10 лет назад