Сколько кг оксида кальция получится при разложении 250 кг карбоната кальция, содержащего 20% примесей? Какоё обьём (н.у.) углекислого газа - оксида углерода (IV) при этом выделится?
Помогите, пожалуйста (8 класс). Желательно с алгоритмом действий.
Ответы
Ответ дал:
0
1) Находим массу примесей
250*100/20=50кг
2) Находим массу СаСО3
250-50=200кг=200*103г
3)CaCO3=CaO+CO2
n=m/M(Mr) M=Mr Mr(CaCO3)=100 M=100г/моль
n(CaCO3)=200*106/100=2*103моль
n(CaCO3) : n(CaO)= 1 :1, след., n(CaO)=2*103моль Mr(CaO)=56 M=56г/моль
m(CaO0=2*106*56=112*103г=112кг
n(CaCO3): n(CO2)= 1 :1, след. n(CO2)=2*103моль
V=n*Vm V(CO2)=2*103*22,4=44,8м3
Ответ: 112кг 44,8м3
250*100/20=50кг
2) Находим массу СаСО3
250-50=200кг=200*103г
3)CaCO3=CaO+CO2
n=m/M(Mr) M=Mr Mr(CaCO3)=100 M=100г/моль
n(CaCO3)=200*106/100=2*103моль
n(CaCO3) : n(CaO)= 1 :1, след., n(CaO)=2*103моль Mr(CaO)=56 M=56г/моль
m(CaO0=2*106*56=112*103г=112кг
n(CaCO3): n(CO2)= 1 :1, след. n(CO2)=2*103моль
V=n*Vm V(CO2)=2*103*22,4=44,8м3
Ответ: 112кг 44,8м3
Ответ дал:
0
вроде бы так получается))
Приложения:
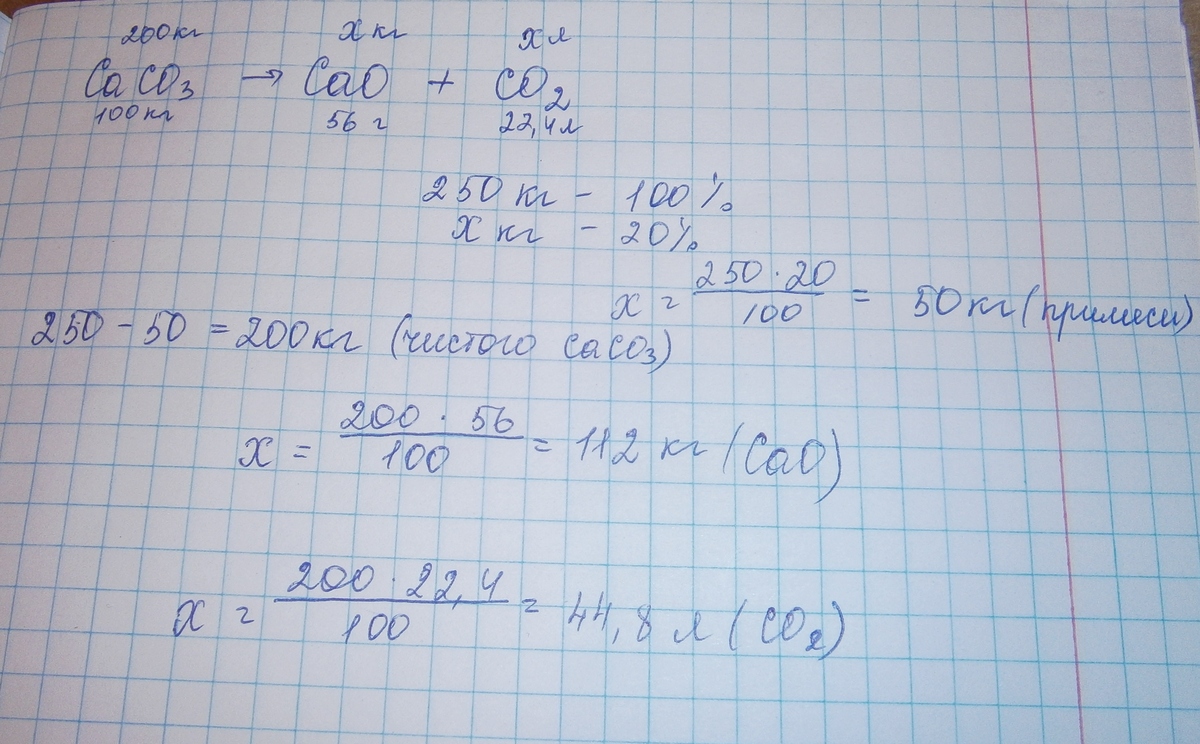
Похожие вопросы
2 года назад
7 лет назад
7 лет назад
10 лет назад
10 лет назад
10 лет назад
10 лет назад