Смесь, массой24 г, состоящая из магния и оксида магния, прореагировала с раствором серной кислоты, в результате чего выделилось6,72 л(н. у.) водорода. Вычисли массовые доли веществ в исходной смеси
Ответы
Ответ дал:
0
Mg+h2so4=Mgso4+h2
mgO+h2so4=Mgso4+h2o
n(H2)=V / Vm=6.72 / 22.4=0.3 моль
n(Mg)=n(H2)
n(Mg)=0.3 моль m(Mg)=n*M=0.3*24=7.2 г
m(MgO)=m(смеси) - m(Mg)=24-7.2=16.8 г
W(MgO)=16.8 / 24 *100=70%
W(Mg)=7.2 / 24 *100=30%
Ответ дал:
0
Решение во вложении:
...........................
Приложения:
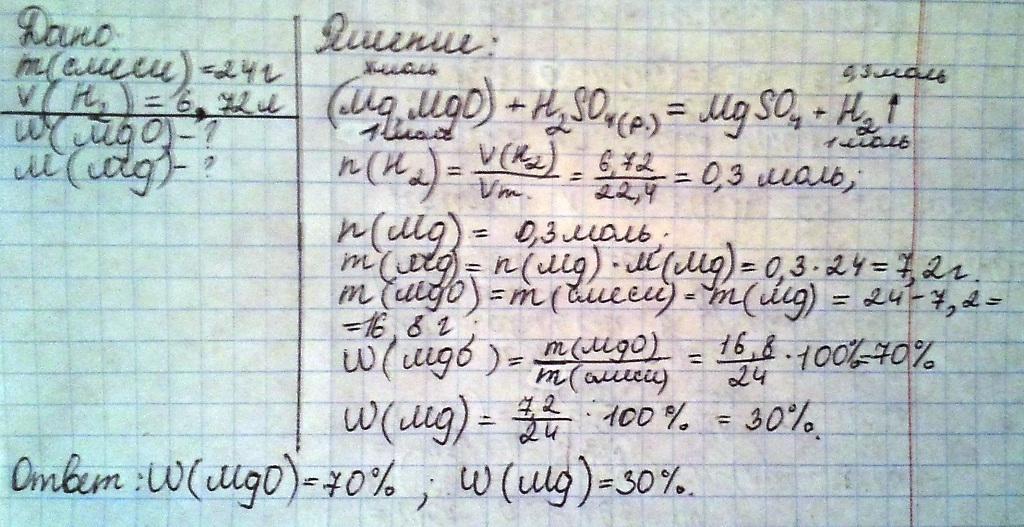
Похожие вопросы
2 года назад
2 года назад
7 лет назад
10 лет назад
10 лет назад