При взаимодействии 3,24 г трехвалентного металла с кислотой выделился водород объемом 4,03 л. Определить молярную массу эквивалента металла и его атомную массу.
Ответы
Ответ дал:
0
По закону эквивалентов:
х - 11.2 л/моль
3.24 г - 4.03 л. отсюда Мэкв(Ме)=9 г/моль
Мэкв(Ме)=М/валентность
отсюда M(ме)= Mэкв * валентность = 9*3 = 27 г/моль
это алюминий
его атомная масса Ar(Al)=27 г/моль (0)
х - 11.2 л/моль
3.24 г - 4.03 л. отсюда Мэкв(Ме)=9 г/моль
Мэкв(Ме)=М/валентность
отсюда M(ме)= Mэкв * валентность = 9*3 = 27 г/моль
это алюминий
его атомная масса Ar(Al)=27 г/моль (0)
Приложения:
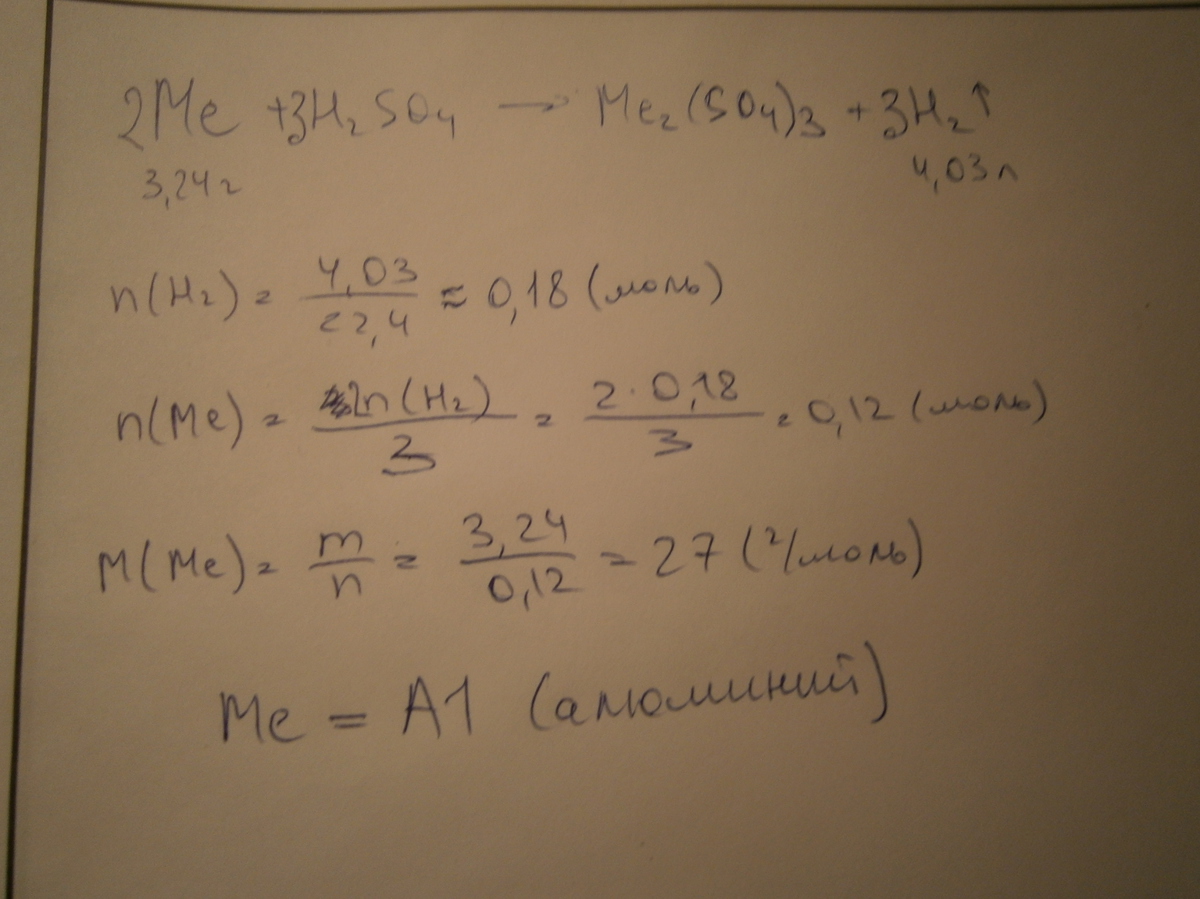
Похожие вопросы
2 года назад
2 года назад
7 лет назад
9 лет назад
9 лет назад
10 лет назад